

|
2)実験
2−1)試薬及び器具 次の試薬は市販品をそのまま用いた。試薬で特に示していない物は1級試薬である。ヘキサヒドロキソアンチモン酸カリウム(キシダ化学)塩酸(キシダ化学)塩化ナトリウム(キシダ化学)アセトン(キシダ化学)。次の試薬は市販品にモレキュラーシーブ3A (ガスクロマトグラフィー用) を5%w/wそのままいれて使用した。メタノール(和光純薬工業)エタノール(和光純薬工業)アセトニトリル(キシダ化学)。次の試薬は市販品にモレキュラーシーブ4A (ガスクロマトグラフィー用)を 5%w/wそのままいれて使用した。ジエチルエーテル (キシダ化学)クロロホルム(キシダ化学) ジクロロメタン(キシダ化学、特級)ジクロロエタン(キシダ化学)ヘキサン(キシダ化学)酢酸エチル(キシダ化学)ジメチルスルホキシド(キシダ化学)トルエン(キシダ化学)。また、溶液中のスペクトル測定に用いたアセトニトリルは五酸化二リンで乾燥させた後窒素下で蒸留して使用した。イオン交換水は研究室にあるイオン交換水製造装置 Pure Line を用いて調製した。テトラブチルアンモニウムヒドロキシド水溶液 ( 東京化成、10% in water ) は、そのまま用いた場合と、塩酸で標定して濃度を決定して (標定の結果濃度は 11% in water であった) 用いた場合がある。塩酸の標定に用いた炭酸水素カリウム(和光純薬工業、特級)は硫酸デシケーターで一日乾燥させて使用した。電位差滴定時に用いたテトラブチルアンモニウムヒドロキシド水溶液はフタル酸水素カリウム(富山薬品工業、標準試薬)で標定して使用した。フタル酸水素カリウムは100。Cで3時間乾燥させた後、硫酸デシケーターで一日放冷させて使用した。pH試験紙は東洋濾紙製UNIVERSAL試験紙 (pH 1-11) を用いた。また、陽イオン交換樹脂は Dowex HCR-W2 を用いた。使用方法はすべてカラム法である。この樹脂をカラムに詰めた後、1N 塩化ナトリウム水溶液、水、1N 塩酸、水の順でカラムに通すというサイクルを5回繰り返して樹脂の洗浄及びコンディショニングをして使用した。陽イオン交換樹脂の交換容量は、標定した塩酸の樹脂を通す前の濃度と通した後の濃度の差から求めた。 本研究ではカラムA [ 直径13mm、長さ22cm、樹脂約16ml、交換容量22mmol (このカラム中の樹脂は既に詰められていたものを使用) ]、もしくはカラムB [ 直径25mm、長さ60cm、樹脂0.90g、交換容量235mmol (新しく作成したもの) ] の2種類を用いた。なお、K[Sb(OH)6]水溶液は冷えるとK[Sb(OH)6]が析出してしまうため、溶液の保温対策としてカラムAには包帯を、カラムBにはリボンヒーターを巻き付けた。実験2−3、2−4はカラムAを、その他の実験はカラムBを用いた。 2−2)分析及び測定 IRスペクトルの測定は日立I−3000赤外分光光度計を用いた。固体物のIRはKRS-5ディスクを用い、Nujol 法で測定した。溶液中の化合物のIRはKRS-5セル(セルの厚さ0.03mm)を用い、蒸留したアセトニトリルを溶媒として測定した。測定範囲は4000−250cm-1である。 1H NMRスペクトルはVarian 社のUnity-plus(300MHz), 日本電子のJMN- a400 (400MHz) を用いて測定した。溶媒としては重メタノール、重アセトニトリル、重ジメチルスルホキシドを用いた。これらの重溶媒は3Aのモレキュラーシーブス5%w/wをいれて一日放置して脱水して使用した。ケミカルシフトはテトラメチルシラン (TMS) の値を基準(0ppm)とした。 元素分析は東レリサーチセンターに依頼した。 X線結晶構造解析は姫路工業大学理学部の小澤芳樹博士に依頼した。 2−3)ポリアンチモン酸塩の合成 過去のポリアンチモン酸の研究は水溶液系で行われていた。しかしその系ではポリアンチモン酸やその塩は殆ど不溶性の沈殿もしくはアモルファスになり、化合物のキャラクタライズが出来なかった。ヘキサヒドロキソアンチモン酸H[Sb(OH)6]はアルカリ金属と反応性が高い。そのためアルカリ金属塩が沈殿しやすく、結晶化し難い。同様にヘキサヒドロキソアンチモン酸が縮合しポリマー化したポリアンチモン酸のアルカリ金属塩も結晶化は難しいと考えられる。逆に可能であればすでに単離されていてもおかしくはない。そこで本研究ではカウンターカチオンとしてテトラブチルアンモニウム ( 以下 TBA と略記 ) を用いることにした。 カウンターカチオンに TBA を用いたポリ酸塩の合成はモリブデンやタングステン、バナジウムのポリ酸イオンの研究で行われている10)。 TBA 塩はアルカリ金属塩に比べて結晶性が悪くなるが、有機溶媒に溶解するポリ酸塩が得られるという長所がある。従って結晶化を行う時に溶媒選択の幅が広がるという利点がある。また有機溶媒系において、TBA 塩を出発物質として水溶液系では単離されていない新種のポリ酸イオン11)や有機金属基を担持したポリ酸イオン12)が合成可能にな溶液中でのポリ酸イオンの動的挙動の研究も可能となる等、有用性が大きい。 従って、ポリアンチモン酸イオンのTBA塩を得ることが出来れば、今後のポリアンチモン酸の化学の研究の発展が期待できる。 本実験では、水溶液中で形成されたポリアンチモン酸イオンをTBA 塩の粗製物として水溶液系から取り出した後、それを有機溶媒中で結晶化を試みる、という方法を用いることにした。具体的には、まず陽イオン交換樹脂を用いてK[Sb(OH)6]溶液から調製したH[Sb(OH)6]水溶液にTBAOH水溶液を加えた後、溶媒を除去してポリアンチモン酸塩であると思われる組成物を合成し、その組成物を有機溶媒中で結晶化する、という方法である。そこで合成の手がかりとしてポリアンチモン酸イオンのドデカマーアニオン、Sb12(OH)644-の報告に注目し、次のような反応でこのアニオンの塩が得られないかと考えた。 12H[Sb(OH)6] + 4TBAOH → TBA4Sb12(OH)64 + 12H2O この反応式を基本にしてH[Sb(OH)6] とTBAOHの混合比を変化させて粗製物の合成を行い、結晶化を試みることにした。 2−3−1)H[Sb(OH)6] : TBAOH = 3 : 1 の合成 陽イオン交換樹脂を詰めたカラムAに、K[Sb(OH)6] 2.0g (7,6mmol) を溶かした溶液200ml、更に温水200mlを通して (pH試験紙で流出液がpH=7になるまで) H[Sb(OH)6] 溶液約400mlを調製し、TBAOH水溶液 (10% in water) 7.5g (2.5mmol) を加えた。使用したTBAOH水溶液は標定せずに用いた。この溶液の溶媒をロータリーエバポレーターで除去したところ、若干吸湿性のある無色の固体が得られた。この物質をジエチルエーテルで洗浄 (20ml エ 5) し、シュレンク管中で8時間真空乾燥 (圧力0.05mmHg)した。収量1.2gであった。 2−3−2)H[Sb(OH)6] : TBAOH = 1 : 1 の合成 陽イオン交換樹脂を詰めたカラムAに、K[Sb(OH)6] 2.0g (7,6mmol) を溶かした溶液200ml、更に温水200mlを通して (pH試験紙で流出液がpH=7になるまで) H[Sb(OH)6] 溶液約400mlを調製しTBAOH水溶液 (10% in water ) 22.5g (7.5mmol) を加えた。使用したTBAOH水溶液は標定せずに用いた。この溶液の溶媒をロータリーエバポレーターで除去しようとしたが、生成物の吸湿性が大きいためか完全には除去できず、ドロドロとした無色の物質が得られた。この物質をジエチルエーテルで洗浄 (50ml エ 5) し、シュレンク管中で8時間真空乾燥 (圧力0.05mmHg)した。吸湿性があまりにも大きいため、収量をはかることは出来なかった。 2−3−3) H[Sb(OH)6] : TBAOH = 2 : 1の合成 陽イオン交換樹脂を詰めたカラムAに、K[Sb(OH)6] 2.0g (7,6mmol) を溶かした溶液200ml、更に温水200mlを通して (pH試験紙で流出液がpH=7になるまで) H[Sb(OH)6] 溶液約400mlを調製しTBAOH水溶液 (10% in water ) 9.8g (3.8mmol) を加えた。使用したTBAOH水溶液は標定せずに用いた。この溶液の溶媒をロータリーエバポレーターで除去すると吸湿性の無色の固体が得られた。この物質をジエチルエーテルで洗浄 (50ml エ 5) し、シュレンク管中で8時間真空乾燥 (圧力0.05mmHg)した。収量 2.1gであった。 2−3−4)H[Sb(OH)6] : TBAOH = 2 : 1で得られた粗製物の結晶化 粗製物は吸湿性があるため、これらを量り取る時は窒素下で行ったが、それ以外はオープンな状態で行った。 (a) アセトニトリル中での結晶化の試み シュレンク管中で粗製物0.5gをアセトニトリル1.0mlに溶かしジエチルエーテルを撹拌しながらわずかに溶液が白く曇り出すところまで加えた。この溶液をヒートガンで温めたが、溶液のわずかな白みが消えなかったので、そのまま冷凍庫 (-10C。) に入れた。白色沈殿が生じただけで結晶は得られなかった。また、ジエチルエーテルのかわりにトルエンを加えても結晶を得ることは出来なかった。 (b) ジクロロエタン中での結晶化の試み シュレンク管中で粗製物0.5gをジクロロエタン1.0mlに溶かしジエチルエーテルを撹拌しながらわずかに溶液が白く曇り出すところまで加えた。この溶液をヒートガンで温めた。しかし、溶液のわずかな白みが消えなかったので、そのまま冷凍庫に入れた。しかし、アセトニトリルの時と同様に白色沈殿が生じただけで結晶は得られなかった。 (c) クロロホルム中での結晶化 シュレンク管中で粗製物0.5gをクロロホルム1.0mlに溶かしジエチルエーテルを撹拌しながらわずかに溶液が白く曇り出すところまで加えた。この溶液をヒートガンで温めた。しかし、溶液のわずかな白みが消えなかったので、そのまま冷凍庫に入れた。3日後、結晶が析出していたが少量であったのでスケールを3倍にして結晶化を行った。3日後、カニュラでろ過し (ろ紙はNo.5A) を使用、8時間真空乾燥した。収量0.06g、粗製物に対する収率4%であった。 IR(図2) ( KRS-5, 1000−400 cm-1 ) 968 (w), 942 (w), 882 (w), 784 (m), 708 (s), 594 (s), 540 (m), 456 (m), 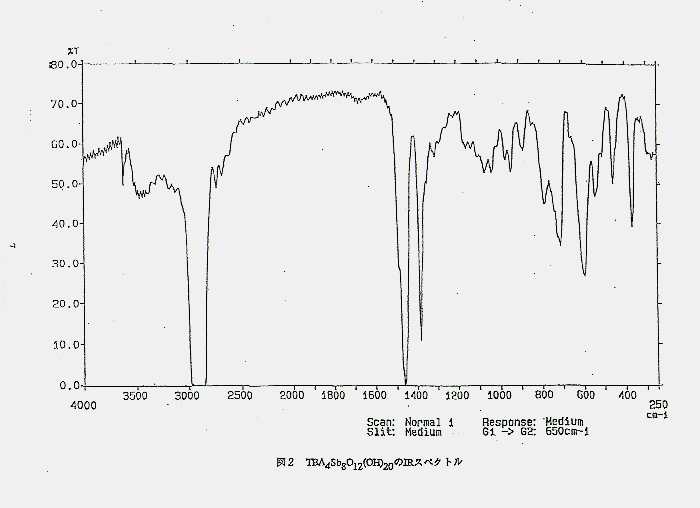 (d) 拡散法による結晶化 シュレンク管中で粗製物2.0gをクロロホルム4.0mlに溶かしジエチルエーテル2.0mlを二層になるようにゆっくり加えた後そのまま室温で放置した。1日後、針状結晶が析出した。7日後、カニュラでろ過し (ろ紙はNo.5A) 、8時間真空乾燥させた。収量0.21g。IRスペクトルは(c)で得られた結晶のものと一致した。 (e)結晶の再結晶 シュレンク管中で結晶0.3gをアセトニトリル2.0mlに溶かしジエチルエーテル7.0mlを二層になるようにゆっくりと加えたところすぐに溶液が白濁し、微結晶が沈殿した。この微結晶をカニュラでろ過した後 (ろ紙はNo.5A) 、ジエチルエーテルで洗浄 (10ml エ 2) し8時間真空乾燥させた。収量0.08gであった。IRスペクトルは(c)で得られた結晶のものと一致した。 元素分析値 Calcd for TBA2Sb4O11・6H2O (C32H84N2Sb4O17): C, 30.61; H, 6.70; N, 2.23; Sb 38.8. Found : C, 30.19; H, 6.86; N, 2.19; Sb, 39.3. 2−3−5)結果と考察 H[Sb(OH)6] : TBAOH = 3 : 1の合成で得られた粗製物はアセトニトリル、ジクロロメタン、クロロホルム、アセトン、テトラヒドロフラン、ジエチルエーテル、トルエン、酢酸エチルには不溶、ジメチルスルホキシド、ジメチルホルムアミド、エタノール、メタノールには難溶であった。このように溶媒に対して溶解性がかなり悪く、結晶化出来なかった。また、IRスペクトルもきれいなものが得られなかった。従ってこの粗製物が実際にポリアンチモン酸塩であるかどうかは確認出来なかった。 そこで溶媒に対して溶解性のある粗製物の得るためにH[Sb(OH)6] : TBAOH = 1 : 1の合成を試みたところ、デシケーター中に保管してもドロドロになる程吸湿性がかなり大きい粗製物が得られた。そのため、結晶化を試みることは断念した。ただ、吸湿性の違いから 3 : 1と1 : 1では異なる物質が形成されていると思われる。 以上の結果からH[Sb(OH)6] : TBAOH = 2 : 1で得られる粗製物は結晶化を行うのに適しているのではと考えた。実際に合成したところ、2 : 1で得られた粗製物はアセトニトリル、ジクロロメタン、クロロホルムのような非プロトン性極性溶媒に可溶であった。そこでこの3種類の溶媒で粗製物の結晶化を試みることにした。その結果、アセトニトリル、ジクロロメタンからは結晶を得ることが出来なかったが、クロロホルムを溶媒に用いて結晶化に成功した。しかしながら、再現性がなく、また得られた結晶も少量であったのでIRスペクトルの測定は出来なかった。そこで結晶化の方法を拡散法に変えてみたところ、再現性は確認できたが、針状結晶であった。この結晶ではきれいなIRスペクトルを得ることが出来た。 IRスペクトルには1000−400cm-1の金属−酸素結合吸収帯にアンチモン−酸素結合によると考えられる吸収が見られることからこの結晶はポリアンチモン酸塩である可能性が大きいと考えた。そこで元素分析、及びX線結晶構造解析に適した結晶を得る目的で更に再結晶を拡散法で行った。結晶はクロロホルムに不溶であったため、溶媒にアセトニトリルを用いて行ったが微結晶が生成してしまい、構造解析に適した大きさの結晶は得ることが出来なかった。IRスペクトルから、この微結晶は元の結晶と同一物質と判断し、元素分析を依頼した。その結果、この結晶はTBA2Sb4O11・6H2O の組成を持っていることがわかった。 また、この結晶はアセトニトリルやジクロロエタン、ニトロメタンといった有機溶媒に溶解した。このことからTBA2Sb4O11は discrete な構造であると考えられる (無限のchain構造を持つ金属酸化物は不溶性である) 。従って当初の目的であるポリアンチモン酸塩の結晶化には成功したと考えた。 2−4) 粗製物合成のスケールアップの実験 残された最大の問題は、この化合物の構造の解明である。そのためには結晶構造解析に適した結晶を得なければならない。それを得るには様々な条件で結晶化を試みる必要がある。しかし、 try and error 法で最適な結晶化条件を探すにはこれまで以上に粗製物が必要となる。そこでこの化合物の粗製物の大量合成を目的としてスケールアップを試みた。スケールアップはカラム中の陽イオン交換樹脂の交換容量を大きくし、K[Sb(OH)6]の量を多くすることによって行うことにした。 2−4−1)合成 陽イオン交換樹脂を詰めたカラムB (直径2.5cm, 長さ60cm, 樹脂90g, 交換容量235mmol ) 2本を新しく作成し、それぞれにK[Sb(OH)6] 20.0g (76mmol) を溶かした溶液1000ml、更に温水500mlを通して (pH試験紙で流出液がpH=7になるまで) H[Sb(OH)6] 溶液約3000mlを調製した。この溶液に (n-C4H9)4NOH水溶液 (10% in water ) 9.8g (3.8mmol) を加えた後、溶媒をロータリーエバポレーターで除去すると吸湿性の無色の固体が得られた。8時間真空乾燥 (圧力0.05mmHg)した後、この物質をジエチルエーテルで洗浄 (200ml エ3) し更にシュレンク管中で8時間真空乾燥 (圧力0.05mmHg)した。収量 21.1gであった。 2−4−2) 粗製物の結晶化 上の合成で得られた粗製物の結晶化を試みた。粗製物 2.0gをサンプル管に入れ、クロロホルム4ml に溶かした。そこに (a) 撹拌しながら及び (b) 二層になるようにゆっくりと、ジエチルエーテルを2ml を 加えた後室温で放置するという2種類の方法で 結晶化を試みたところ、結晶を得ることが出来た。しかし少量であったのでスケールを上げて結晶化を行った。粗製物10gをクロロホルム20mlに溶かした。その溶液にジエチルエーテル10mlを二層になるようにゆっくりと加えた。十日後、デカンテーションで結晶を分離し、エーテルで洗浄後、真空乾燥した。収量0.6g、粗製物に対する収率6%であった。IRスペクトルはこれまでの結晶のものと一致した。 元素分析 Calcd for TBA4Sb8O12(OH)20 (C64H164N4Sb8O32): C, 31.05; H, 6.68; N, 2.26; Sb, 39.3. Found: C, 30.79; H, 6.77; N, 2.22; Sb, 38.7. 2−4−3)結果と考察 スケールアップを試みた結果、成功した。また、結晶化の方は(a) , (b) 共に3日後、結晶が析出した。この方法で、偶然ではあるが、X線構造解析に適した結晶を得る事が出来たので姫路工業大学の小澤芳樹博士に構造解析を依頼した。 (a) の方法で得られた結晶を構造解析した結果、この結晶はTBA4Sb8O12(OH)20であることが明らかとなった。(構造解析の詳しい結果は別の章で述べる) また先の元素分析で用いた結晶と構造解析で用いた結晶とは結晶化の条件が異なっているため、この結晶の元素分析を行った。その結果、構造解析で得られた結果を支持するデータが得られた。今回の元素分析結果と最初の元素分析結果とでは異なっているように見えるが、次のように最初の元素分析を行った結晶ではTBA4Sb8O12(OH)20の二水和物が形成されていたと考えると値が一致する。 Calcd for TBA4Sb8O12(OH)20・2H2O (C64H168N4Sb8O34): C, 30.61; H, 6.70; N, 2.23; Sb 38.8. Found : C, 30.19; H, 6.86; N, 2.19; Sb, 39.3. よって次のような反応でTBA4Sb8O12(OH)20が形成されたと考えている。 8H[Sb(OH)6] + 4 TBAOH → TBA4Sb8O12(OH)20 + 8H2O この様に化学量論的にこのポ 過去のポリアンチモン酸の研究は水溶液系で行われていた。しかしその系ではポリアンチモン酸やその塩は殆ど不溶性の沈殿もしくはアモルファスになり、化合物のキャラクタライズが出来なかった。ヘキサヒドロキソアンチモン酸H[Sb(OH)6]はアルカリ金属と反応性が高い。そのためアルカリ金属塩が沈殿しやすく、結晶化し難い。同様にヘキサヒドロキソアンチモン酸が縮合しポリマー化したポリアンチモン酸のアルカリ金属塩も結晶化は難しいと考えられる。逆に可能であればすでに単離されていてもおかしくはない。そこで本研究ではカウンターカチオンとしてテトラブチルアンモニウム ( 以下 TBA と略記 ) を用いることにした。 カウンターカチオンに TBA を用いたポリ酸塩の合成はモリブデンやタングステン、バナジウムのポリ酸イオンの研究で行われている10)。 TBA 塩はアルカリ金属塩に比べて結晶性が悪くなるが、有機溶媒に溶解するポリ酸塩が得られるという長所がある。従って結晶化を行う時に溶媒選択の幅が広がるという利点がある。また有機溶媒系において、TBA 塩を出発物質として水溶液系では単離されていない新種のポリ酸イオン11)や有機金属基を担持したポリ酸イオン12)が合成可能にな溶液中でのポリ酸イオンの動的挙動の研究も可能となる等、有用性が大きい。 従って、ポリアンチモン酸イオンのTBA塩を得ることが出来れば、今後のポリアンチモン酸の化学の研究の発展が期待できる。 本実験では、水溶液中で形成されたポリアンチモン酸イオンをTBA 塩の粗製物として水溶液系から取り出した後、それを有機溶媒中で結晶化を試みる、という方法を用いることにした。具体的には、まず陽イオン交換樹脂を用いてK[Sb(OH)6]溶液から調製したH[Sb(OH)6]水溶液にTBAOH水溶液を加えた後、溶媒を除去してポリアンチモン酸塩であると思われる組成物を合成し、その組成物を有機溶媒中で結晶化する、という方法である。そこで合成の手がかりとしてポリアンチモン酸イオンのドデカマーアニオン、Sb12(OH)644-の報告に注目し、次のような反応でこのアニオンの塩が得られないかと考えた。 12H[Sb(OH)6] + 4TBAOH → TBA4Sb12(OH)64 + 12H2O この反応式を基本にしてH[Sb(OH)6] とTBAOHの混合比を変化させて粗製物の合成を行い、結晶化を試みることにした。 2−5)結晶化における収率改善の実験 これまでにポリアンチモン酸塩の合成並びに結晶化に成功し、構造解析によってその構造を初めて明らかにすることができた。今後、この化合物の性質の解明を行う場合、また新規ポリアンチモン酸を合成していく上で starting material として用いるためには、大量の結晶が必要となる。しかし、実際結晶の収率は粗製物に対して4−7%とかなり低く、このままではポリアンチモン酸の化学の解明には遠く及ばない。そこで結晶化における収率改善を検討した。 収率の悪い原因として、粗製物の合成に用いるTBAOHの濃度が考えられる。 TBAOHは市販品 ( 濃度 10% in water ) をそのまま用いていた。しかし、この 10% という濃度は完全に正確ではない。そのため、H[Sb(OH)6] : TBAOH = 2 : 1 からずれているため、TBA4Sb8O12(OH)20以外のポリアンチモン酸塩が不純物としてかなり含まれていると考えられる。そこでこのTBAOH溶液の濃度を塩酸で標定し、正確な濃度を決定して用いることにした。 2−5−1)合成 陽イオン交換樹脂を詰めたカラムに、K[Sb(OH)6] 20.0g (76mmol) を溶かした溶液2000ml、更に温水1000mlを通して (pH試験紙で流出液がpH=7になるまで) H[Sb(OH)6] 溶液約3000mlを調製した。この溶液に標定済みの (n-C4H9)4NOH水溶液 (11% in water ) 89.9g (38mmol) を加えた後、溶媒をロータリーエバポレーターで除去すると吸湿性の無色の固体が得られた。この物質をジエチルエーテルで洗浄 (200ml エ 3) し、シュレンク管中で8時間真空乾燥 (圧力0.05mmHg)した。収量 22.1gであった。こうして得られた粗製物3.0gをサンプル管にとり、クロロホルム6.0mlに溶かした。そこにジエチルエーテル3.0mlを二層になるようにゆっくりと加えた。十日後、デカンテーションで結晶を分離し、エーテルで洗浄後、デシケーター中で8時間真空乾燥させた。収量0.514g、粗製物に対する収率17 %であった。IRスペクトルはこれまでの結晶と一致した。 2−5−2)結果と考察 この結果、収率はこれまでのおよそ3倍になった。TBAOHを標定して使用した効果が如実に現れている。しかし、これでもまだ20%程度である。粗製物はクロロホルムに溶解するが結晶は溶解しない事を考えると粗製物には不純物が混ざっているのであろう。残りの80%の幾らかはTBA4Sb8O12(OH)20以外のポリアンチモン酸塩か、もしくはH[Sb(OH)6]そのものが固化してしまったような物であろうと思われる。ポリアンチモン酸の平衡が遅いのかもしれない。そのため粗製物の合成の段階で、TBA4Sb8O12(OH)20が形成される前に溶媒を除去している可能性がある。しかし、あまり放置しておくと溶液が白濁してしまうという問題がある。H[Sb(OH)6]は水溶液中では不安定であると考えられる。 2−6)合成実験のまとめ H[Sb(OH)6] : TBAOH = 2 : 1で得られた粗製物の結晶化に成功し、構造解析及び元素分析からTBA4Sb8O12(OH)20というポリアンチモン酸塩が形成されていることがわかった。このポリアンチモン酸塩はアセトニトリル、ジクロロエタン、ニトロメタンといった非プロトン性極性溶媒に溶解する。したがって今後様々なポリアンチモン酸塩の合成を行うのにこの化合物は出発物質として最適である。 また、この粗製物の結晶化は冬季はかなりうまくいくが、夏季はあまり再現性がよくない。冷凍庫や冷蔵庫中でも試してみたが、やはり冬季の室温で結晶化を試みるのがベストのようである。これを解決するのに、カチオンをテトラエチルアンモニウム (TEA) に変えて結晶性をあげる等の方法が考えられる。しかし、予備的な実験ではH[Sb(OH)6] : TEAOH = 2 : 1で得られた粗製物は溶媒に対する溶解性が低く、結晶化が困難であると考えている。多くのポリ酸イオンの塩の合成ではこのような 'cation problem' と呼ばれる問題が付きまとう。これまでポリアンチモン酸塩が単離できなかったのもこの問題が大きいと思われる。 今回はポリアンチモン酸塩の合成には成功したが、遷移金属ポリ酸イオンと比較すると、かなり効率が悪いと言わざるを得ない。今回の方法以外の、ポリアンチモン酸塩の効率の良い合成ルートの開発も今後の研究課題の一つである。 |